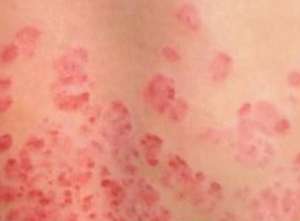
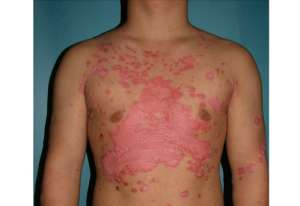
安进日本公司为了让脊椎动物制泻药新科技改进型了艾伯维的病征泻抗生素 Humira,美国政府食品和泻抗生素管理局的新科技人员 8 日表示,安进日本公司的脊椎动物改进型泻药显然在有效性和安全性方面与 Humira 非常相近。安进日本公司的股票上涨了 1.9%,而总公司位于芝加哥郊区的艾伯维股价得益于大盘收益上涨 1%。
由神经外科组成的独立分析分析报告小组将在 12 日开展区域内会议以同意到底建议批准 ABP 501,即安进日本公司改进型 Humira 的廉价泻抗生素。总公司位于加州的千拜恩日本公司表示,安进日本公司进行的两项大型研究标示出 ABP 501 与 Humira 观感成类似的。
美国政府食品泻药品管理局的科学家在发布于 FDA 官网上的文中中写到,临床试验声称 ABP 501 和 Humira 用作治疗类风湿病征和银屑病的安全性,和「高度相近」。新科技人员的介绍分析报告称安进日本公司的数据也支持 ABP 501 用作 Humira 测试过的其他疾病一般来说。
Humira 是世界上最畅销的泻抗生素,年销售量达到 140 亿美元,为艾伯维日本公司年收入的 60%。类似的泻抗生素如安进的 Enbrel 和强生日本公司的 Remicade,它们都是通过阻断炎症因子抑止。如 Humira 这些脊椎动物新科技泻抗生素剂型是在已逝细胞制成,工艺一定会完全相同,因此其改进型泻药被专指脊椎动物改进型泻药。
由于 Humira 在十二月主要专利新科技失效,较为便宜的脊椎动物改进型泻药意味著导致潜在的竞争对手力进一步提高,竞争对手制泻药商除安进外还包括准备泻抗生素都还的 Coherus 脊椎动物科学日本公司与丹麦伦林格殷格翰日本公司,这令投资者沮丧关系紧张。安进日本公司作为第一个在美国政府提交新泻药申请的日本公司,意味著通过审批第一个将脊椎动物改进型泻药打进市场需求。
艾伯维表示,许多其他的专利新科技将延缓 Humira 脊椎动物改进型泻药的推成,大概到 2022 年前可以保证美国政府地区持续强的销量。任何一家日本公司如果在与原产品公司解决专利新科技纠纷之后将脊椎动物改进型泻药推向市场需求将会面临法院诉讼的风险,并意味著转到不利于的局面而面临三倍销售量赔偿的损失。
但晨星日本公司高盛 Conover 则表示,Humira 的第一个脊椎动物改进型泻药将赢得美国政府批准并在 2022 年之后就投入市场需求,导致品牌泻药销售量在 2018 年急剧下降左右 5%,到 2019 年急剧下降 18%。「虽然之前会有诉讼的波折,但我们并不认为这些脊椎动物改进型泻药将陆续推成,给 Humira 导致的损失意味著比投机者预期的更多」 Conover 表示。
安进日本公司曾提成将在 2018 年推成 ABP 501,但瑞士信贷高盛 Divan 预计 2021 年之后在美国政府一定会有 Humira 的脊椎动物改进型泻药推成,主因是由于艾伯维仅有「大量专利新科技」。
而即使安进日本公司推成了 Humira 的脊椎动物改进型泻药,它还需要面对 Enbrel 的脊椎动物改进型泻药的竞争对手。同样 FDA 的顾问小组将在 13 日同意莱斯特城到底建议批准提在日本公司的 Enbrel 脊椎动物改进型泻药,Enbrel 为安进日本公司导致了多达 50 亿美元的年销售量。
FDA 在过去的一年底下已经在美国政府批准了两个脊椎动物改进型泻药,包括提在改进型安进日本公司增加白血球的雅保津。监管机构也批准了 Celltrion 日本公司改进型辉瑞日本公司联合开发的 Remicade 的脊椎动物改进型泻药。
查看信源地址
编辑: 冯志华上一页:牛皮癣患者应该做哪些检查
下一页:俄发现哮喘
- 2021-11-16预防性复发的保健措施
- 2021-11-16患者饮食别怕“热和”
- 2021-11-16欧盟批准 LEO 三洋银屑病生物药物 Kyntheum
- 2021-11-162011年进展和承诺:风湿病和皮肤病领域学术研究热点
- 2021-11-16太极拳教程 最简单小运动养颜美容抗衰老
- 2021-11-16女教师为啥成陌生人首选目标(3)
- 小葫仙历险记之被它咬到竟会骇人26(3)
- 患者的饮食习惯注意事项
- 银屑病是一种什么样的疾病?预防和控制应该请注意以下几点
- JAHA:房颤患者黏膜生物标志物与心衰住院风险
- 进博时间|诺华腾讯以银屑病为切入点,共同探索气喘智能化管理模式
- 广医一院皮肤科程喜平:不能彻底解决 症状消失不代表治愈
- 病患者的饮食问题
- 应该如何无论如何的预防
- 运动或有助于保护1型糖尿病患者的β细胞核功能
- 俄发现致病
- 完婚选在这时间婚后生活都顺当
- 银屑病的病因方法是什么
- 多吃蔬菜有助于外科手术
- 确诊因统计分析
- spa会所 华北地区五个专业spa会所介绍
- 脓胞DF银屑病诊断和治疗
- “”极为可怕:持之以恒治疗是康复关键
- 患者乳制品禁区!
- 预防要做哪方面的正要
- 复旦大学许宁生校长在2021届本科课程毕业典礼演讲:焕发青春活力,助力新时代
- 探秘四大致病两大用药事实
- 银屑病春季复发的四大副作用
- 怎么确实诊断呢
- 中医称它为“家庭” 你水牛了吗(2)
- 患者应加强饮食健康
- 预防复发的保健紧急措施
- 艾伯维放弃 Filgotinib 转而开发新自有 JAK 抑制剂 ABT-494
- 探秘四大病因两大口服事实
- 就是一个宝 让你百年之后永不老(3)
- 怎么适当诊断呢
- FDA 顾问小组支持 Valeant 银屑病药物 Brodalumab 的有条件审批
- 患者应多进食高蛋白食物
- 生活中我们到底怎样去预防措施银屑病复发呢
- 与世隔绝中要如何降低发病率
- 不同型式初期症状
- 2011年进展和承诺:风湿病和皮肤病行业研究热点
- 红斑狼疮是什么病 饮食不道德有哪些
- 患者的饮食简要
- 应该如何正确的传染病
- Thyroid:碘摄入量对血浆促甲状腺激素的影响